酸碱度(pH)与碱度(ALK)全景解析:从基础概念到实操应用
-
2025年10月28日
-
点击量:705
编辑:微纳(VVNA)
来源:微纳水质分析仪器(深圳)有限公司
在水质监测、工业生产、环境治理等诸多领域,酸碱度(pH)与碱度(ALK)是两个高频出现的核心指标。二者既相互关联又存在本质区别,准确理解其定义、计算方法及内在关系,是开展相关工作的基础。本文将从基础概念入手,结合实例演算、测定方法及拓展知识,全方位拆解酸碱度与碱度的核心要点,为实操应用提供清晰指引。
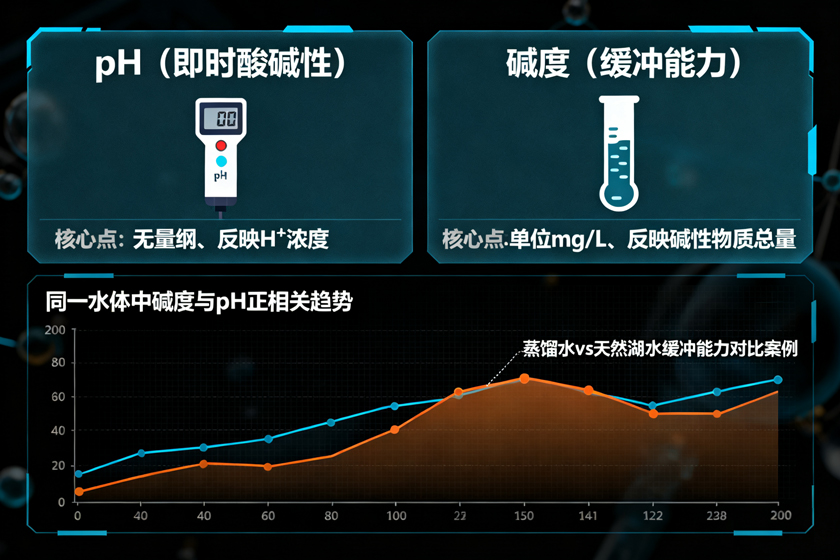
一、酸碱度(pH):水溶液酸碱性的“直观标尺”
酸碱度是描述水溶液酸碱性强弱的核心指标,日常生活中我们常说的“酸性水”“碱性水”,其判断依据就是pH值。它通过量化水中氢离子浓度,直接反映溶液的酸碱性状态。
核心定义与量化逻辑
适用范围与常见误区
常用测定方法
pH又称氢离子浓度指数,其本质是水中氢离子浓度([H⁺])的负对数,计算公式为:pH = -log₁₀[H⁺],该指标无量纲,取值范围通常在0-14之间,不同数值对应不同的酸碱性:
中性溶液:pH=7,此时水中氢离子浓度与氢氧根离子浓度相等([H⁺]=[OH⁻]);
酸性溶液:pH<7,数值越小,氢离子浓度越高,酸性越强;
碱性溶液:pH>7,数值越大,氢氧根离子浓度越高,碱性越强。
为更直观理解pH的计算逻辑,结合具体实例说明:
25℃时,1L纯水中仅有1×10⁻⁷mol的水分子发生电离,此时[H⁺]=[OH⁻]=1×10⁻⁷mol/L,代入公式可得pH=-log₁₀(1×10⁻⁷)=7,呈中性;
实验室常用的0.1mol/L盐酸(强酸,完全电离),其[H⁺]=0.1mol/L,计算得pH=-log₁₀(0.1)=1,呈强酸性;
0.1mol/L氢氧化钠溶液(强碱,完全电离),其[OH⁻]=0.1mol/L,结合25℃时水的离子积常数Kw=1×10⁻¹⁴(下文详细讲解),可算出[H⁺]=1×10⁻¹³mol/L,pH=-log₁₀(1×10⁻¹³)=13,呈强碱性。
pH指标并非适用于所有场景,其应用存在明确限制,需规避以下误区:
仅适用于稀水溶液:非水溶液(如乙醇、丙酮等溶剂体系)中,pH=7不代表中性,需根据该溶剂的离子积常数重新判断;
高浓度溶液不适用:当氢离子或氢氧根离子浓度大于1mol/L时,pH值会超出0-14的常规范围(如1mol/L盐酸pH=0,1mol/L氢氧化钠pH=14),此时直接用浓度表示更准确,浓硫酸、氢氧化钠固体等纯物质或高浓度溶液,均不适合用pH表征酸碱性。
根据精度需求不同,pH测定可选择不同工具,常见方法包括:
pH试纸:操作简便、成本低,适合快速定性或半定量检测,精度较低(通常精确到0.5-1个pH单位);
pH指示剂:通过指示剂颜色变化判断pH范围,如酚酞(pH8.2-10.0变色)、甲基橙(pH3.1-4.4变色),适用于酸碱滴定中的终点判断;
pH计:又称酸度计,通过电极直接测量氢离子浓度,精度高(可精确到0.01甚至0.001个pH单位),适合定量检测,广泛应用于实验室及工业场景。
二、碱度(ALK):水溶液缓冲能力的“核心指标”
与pH直接反映酸碱性不同,碱度描述的是水溶液接受氢离子(H⁺)的能力,即中和强酸的能力。它代表了水中碱性物质的总含量,是衡量水体缓冲能力的关键指标。
定义与核心组成
量化计算与单位换算
碱度是指水中能与强酸发生中和反应的物质总量,本质是水中所有能接受H⁺的物质的总和,主要包括强碱(如NaOH)、弱碱(如NH₃·H₂O)、强碱弱酸盐(如Na₂CO₃、NaHCO₃)等。
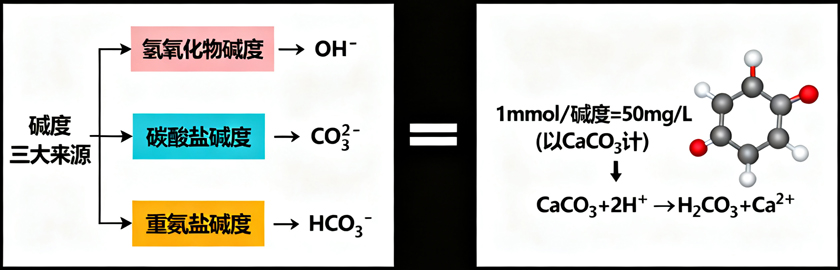
在自然水体中,氨、磷酸盐等碱性物质含量极低,碱度主要由三类物质贡献,按化学形态可分为:
氢氧化物碱度:由OH⁻离子提供;
碳酸盐碱度:由CO₃²⁻离子提供;
重碳酸盐碱度:由HCO₃⁻离子提供。
碱度的量化需结合化学计量关系,核心计算逻辑及单位换算如下:
从接受H⁺的摩尔量角度,碱度(单位:mmol/L)的理论计算公式为:碱度(mmol/L)= [OH⁻] + [HCO₃⁻] + 2[CO₃²⁻]。公式中系数“2”的原因是:1个CO₃²⁻离子可接受2个H⁺(CO₃²⁻ + 2H⁺ → H₂CO₃),而OH⁻和HCO₃⁻各接受1个H⁺(OH⁻ + H⁺ → H₂O;HCO₃⁻ + H⁺ → H₂CO₃)。
碱度(mmol/L)= [OH⁻] + [HCO₃⁻] + 2[CO₃²⁻]
公式中系数“2”的原因是:1个CO₃²⁻离子可接受2个H⁺(CO₃²⁻ + 2H⁺ → H₂CO₃),而OH⁻和HCO₃⁻各接受1个H⁺(OH⁻ + H⁺ → H₂O;HCO₃⁻ + H⁺ → H₂CO₃)。
实际检测中,碱度通过标准酸溶液滴定测定,结果通常以碳酸钙(CaCO₃)为基准进行换算,单位为mg/L(以CaCO₃计)。换算逻辑结合化学方程式推导:以CaCO₃与H⁺的中和反应为例:CaCO₃ + 2H⁺ → H₂CO₃ + Ca²⁺。由反应式可知,1mol CaCO₃可中和2mol H⁺。若某溶液碱度为1mmol/L(即接受H⁺的能力为1mmol/L),则换算为CaCO₃的质量浓度为:碱度(mg/L,以CaCO₃计)= (1mmol/L × 100g/mol)÷ 2 = 50mg/L。其中100g/mol为CaCO₃的摩尔质量,除以2是因为1mol CaCO₃对应2mol H⁺。
其中100g/mol为CaCO₃的摩尔质量,除以2是因为1mol CaCO₃对应2mol H⁺。
三、酸碱度与碱度的核心关系解析
pH与碱度是两个极易混淆的指标,二者既有一定关联性,又存在本质区别,准确区分是掌握其应用的关键。
本质区别:从“直接表现”到“缓冲能力”
实践关联:缓冲能力的“直观体现”
pH与碱度的核心区别体现在三个维度:
| 对比维度 | 酸碱度(pH) | 碱度(ALK) |
| 核心含义 | 直接反映水中H⁺/OH⁻浓度,是酸碱性的“即时表现” | 反映水中碱性物质总量,是缓冲能力的“内在基础” |
| 量化对象 | 单一离子(H⁺)的浓度(负对数形式) | 多种碱性物质的总量(OH⁻、HCO₃⁻、CO₃²⁻等) |
| 单位特征 | 无量纲(0-14范围) | 有单位(mmol/L或mg/L,以CaCO₃计) |
| 数值关联性 | 无明确一一对应关系,碱度相同pH可能不同,反之亦然 | |
虽然pH与碱度无严格对应关系,但在实际应用中存在明显关联性:
趋势相关性:同一类水体中,碱度越高,通常pH也越高;碱度越低,pH也越低。例如,高碱度的地下水pH多在8.0-8.5之间,而低碱度的雨水pH常低于6.0;
缓冲能力的核心:碱度是水体pH缓冲能力的核心来源。碱度越高,水体抵抗pH变化的能力越强——向水中加入少量酸或碱时,pH变化幅度小;碱度越低,缓冲能力越弱,pH易随外界干扰发生剧烈波动。例如,蒸馏水碱度几乎为0,加入少量盐酸后pH会迅速从7.0降至1.0左右;而天然湖水因含有一定碱度,加入相同量盐酸后pH变化可能仅0.5-1.0个单位。
四、碱度的实操测定方法
碱度的测定是水质分析的常规项目,目前应用最广泛的是酸碱指示剂滴定法,该方法通过两次滴定分别测定酚酞碱度和甲基橙碱度,最终计算总碱度。
核心原理与滴定流程
第一步:酚酞碱度测定:向水样中加入酚酞指示剂,用标准酸滴定至溶液由红色变为无色(此时pH≈8.3),记录消耗酸的体积为P mL,该体积对应的碱度为酚酞碱度;
第二步:甲基橙碱度测定:在上述滴定后的溶液中加入甲基橙指示剂,继续用标准酸滴定至溶液由黄色变为橙红色(此时pH≈4.4-4.5),记录此次消耗酸的体积为M mL,该体积对应的碱度为甲基橙碱度;
总碱度计算:总碱度(ALK)= 酚酞碱度 + 甲基橙碱度,即通过消耗酸的总体积(P+M)折算为以CaCO₃计的质量浓度。
标准依据与参考资料
利用酸碱中和反应,以盐酸或硫酸为标准酸溶液,通过不同指示剂的变色点判断滴定终点,分两步完成测定:
该测定方法的详细操作步骤、试剂配制及计算细则,可参考《水和废水监测分析方法(第四版)》第120页。
五、拓展知识:读懂水的电离与相关概念
要深入理解pH与碱度,需掌握水的电离规律、离子积常数等基础概念,这些知识是解析酸碱性本质的关键。
水的离子积常数(Kw)
pOH:氢氧根离子浓度的“镜像指标”
摩尔质量:定量计算的“基础工具”
水是弱电解质,会发生微弱电离:H₂O ⇌ H⁺ + OH⁻。水的离子积常数Kw是描述该电离平衡的核心参数,定义为水中氢离子浓度与氢氧根离子浓度的乘积:Kw = [H⁺]·[OH⁻]。
Kw具有明确的温度依赖性,仅随温度变化而变化,是温度常数,常见温度下的Kw值及对应中性pH:
25℃时:Kw=1×10⁻¹⁴,此时[H⁺]=[OH⁻]=1×10⁻⁷mol/L,pH=7(中性);
100℃时:Kw=1×10⁻¹²,此时[H⁺]=[OH⁻]=1×10⁻⁶mol/L,pH=6(中性)。
这一特性说明:“pH=7呈中性”是25℃水溶液的专属结论,温度变化或溶剂改变时,中性pH值会随之变化。例如,100℃的纯水pH=6,但仍呈中性;非水溶液中pH=7更不能直接判定为中性。
与pH对应,pOH定义为氢氧根离子浓度的负对数:pOH = -log₁₀[OH⁻]。根据Kw=[H⁺]·[OH⁻],两边取负对数可得:pH + pOH = -log₁₀Kw。
25℃时Kw=1×10⁻¹⁴,因此该温度下pH + pOH=14。通过这一关系,已知pH可直接计算pOH,反之亦然。例如,25℃时pH=13的氢氧化钠溶液,pOH=14-13=1,对应[OH⁻]=0.1mol/L,与前文实例一致。
摩尔质量是化学定量计算的核心参数,单位为g/mol,数值上等于物质的相对原子质量或相对分子质量(如H的摩尔质量为1g/mol,CaCO₃为100g/mol)。当物质的量为a mol时,其质量计算公式为:质量(g)= a mol × 摩尔质量(g/mol)。
前文碱度换算中,CaCO₃的质量计算就依赖这一关系,掌握摩尔质量的应用是实现酸碱相关定量计算的基础。
结语:从理论到实践的核心应用逻辑
酸碱度(pH)与碱度(ALK)虽同属水质酸碱特性指标,但前者是酸碱性的“即时快照”,后者是缓冲能力的“内在储备”。在实际应用中,需明确二者的区别与关联:通过pH快速判断水体当前酸碱性,通过碱度评估水体抵抗pH变化的能力。无论是水质监测、工业水处理还是环境治理,只有同时掌握这两个指标的核心知识及测定方法,才能实现精准分析与科学决策。
微信扫一扫分享给朋友
-

- 关注VVNA公众号
随时了解公司最新动态


 水质应急检测解决方案
水质应急检测解决方案  粤ICP备2025457676号-1
粤ICP备2025457676号-1